Kaliumformiaat
Kaliumformiaat (KHCO2) is het kaliumzout van mierenzuur. Het kent niet veel toepassingen, alhoewel een oplossing van dit zout in water wordt gebruikt als strooizout in specifieke toepassingen, bijvoorbeeld op landingsbanen.[1]
Kaliumformiaat
| ||||
| Structuurformule en molecuulmodel | ||||
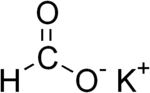 | ||||
Structuurformule van kaliumformiaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | KHCO2 | |||
| IUPAC-naam | kaliummethanoaat | |||
| Molmassa | 84,11574 g/mol | |||
| SMILES | C([O-])=O.[K+] | |||
| CAS-nummer | 590-29-4 | |||
| PubChem | 2735122 | |||
| Beschrijving | Kleurloze kristallen | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,908 g/cm³ | |||
| Smeltpunt | 167,5 °C | |||
| Oplosbaarheid in water | (bij 0°C) 328 g/L (bij 80°C) 6570 g/l | |||
| Goed oplosbaar in | ethanol, water | |||
| Onoplosbaar in | di-ethylether | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Het wordt ook toegepast in secundaire koelvloeistofmengsels omwille van de gunstige eigenschappen hiervoor, namelijk het verlagen van het vriespunt zonder de viscositeit of warmtecapaciteit (ten opzichte van zuiver water) veel te veranderen.
Synthese
Kaliumformiaat wordt bereid door de reactie van koolstofmonoxide met kaliumhydroxide:
Een alternatief is de zuur-basereactie tussen mierenzuur en kaliumhydroxide:
Een commercieel bruikbare reactie is die tussen formaldehyde, kaliumhydroxide en 2-methylpropanal, waarbij commercieel waardevol 2,2-dimethyl-1,3-propaandiol als bijproduct ontstaat:[2]
Externe links
- (en) Gegevens van kaliumformiaat op prochemonline.com
- (en) Gegevens van Kaliumformiaat in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
| Bronnen, noten en/of referenties |