IJzer(III)acetaat
IJzer(III)acetaat is een zout van azijnzuur en driewaardig ijzer. Het heeft een bruinrode kleur en lost goed op in water. De chemische formule is (CH3COO)3Fe. Bij verhitting ontbindt de stof in ijzer(III)oxide, aceton en koolstofdioxide.[1] Verwarmen van een oplossing van ijzer(III)acetaat levert de onoplosbare verbinding ijzer(III)acetaathydroxide (Fe(CH3COO)(OH)2).
IJzer(III)acetaat
| ||||
| Structuurformule en molecuulmodel | ||||
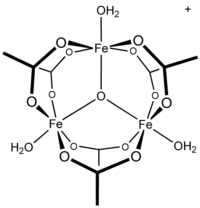 | ||||
Structuurformule van ijzeracetaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C14H27Fe3O18 | |||
| IUPAC-naam | ijzer(III)ethanoaat | |||
| Andere namen | ijzertriacetaat | |||
| Molmassa | 650,9 g/mol | |||
| SMILES | CC(=O)[O-].CC(=O)[O-].CC(=O)[O-].[Fe+3] | |||
| InChI | 1/3C2H4O2.Fe/c3*1-2(3)4;/h3*1H3,(H,3,4);/q;;;+3/p-3/f3C2H3O2.Fe/q3*-1;m | |||
| CAS-nummer | 1834-30-6 | |||
| EG-nummer | 217-396-8 | |||
| PubChem | 164887 | |||
| Vergelijkbaar met | ijzer(II)acetaat, ijzer(III)acetaathydroxide | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | bruinrood | |||
| Goed oplosbaar in | water, ethanol | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
IJzer(III)acetaat komt overal in de natuur voor, ook in het menselijk lichaam. IJzer(III)acetaat verhoogt het ijzergehalte in ons bloed en is gezond maar een overdosis kan dodelijk zijn. Men heeft ongeveer 0,2 mg per dag nodig. IJzer is een van de sporenelementen die nodig zijn voor zowel dier als plant. Extra inname is niet nodig want normaal gesproken krijg je genoeg ijzer binnen.
IJzer(III)acetaat wordt bereid door ijzervijlsel, waterstofperoxide en azijnzuur met elkaar te verhitten bij 117 °C. Een andere methode bestaat uit de reactie van ijzer(III)chloride met natriumacetaat.
IJzer(III)acetaat wordt gebruikt als kleurstof en om het ijzergehalte aan te vullen in grond voor planten.
Bronnen, noten en/of referenties
|