Difenyldisulfide
Difenyldisulfide is een organische verbinding met de formule (C6H5S)2. De formule wordt vaak afgekort tot Ph2S2 of PhSSPh. In de organische synthese is deze stof een van de meest gebruikte disulfiden. De doorgaans aanwezige, maar kleine verontreiniging met thiofenol is verantwoordelijk voor de onprettige geur die deze verbinding meestal verspreidt.
Difenyldisulfide
| ||||
| Structuurformule en molecuulmodel | ||||
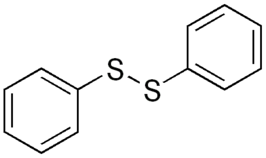 | ||||
 | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C12H10S2 | |||
| IUPAC-naam | Difenyldisulfide | |||
| Molmassa | 218,36 g/mol | |||
| SMILES | c1ccc(cc1)SSc2ccccc2 | |||
| CAS-nummer | 882-33-7 | |||
| PubChem | 13436 | |||
| Beschrijving | Kleurloze kristallen | |||
| Vergelijkbaar met | thiofenol, difenyldiselenide | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 - H400[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P273 - P305+P351+P338[1] | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Smeltpunt | 61–62 °C | |||
| Goed oplosbaar in | di-ethylether, benzeen, koolstofdisulfide, THF | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0 D | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese en structuur
De synthese van Ph2S2 verloopt meestal via de oxidatie van thiofenol:
- 2 PhSH + I2 → Ph2S2 + 2 HI
Waterstofperoxide kan ook de rol van oxidator spelen.[2]Ph2S2 wordt maar zelden in het laboratorium bereid: de stof is goedkoop (± € 150.= /kg[1]) en bovendien stinkt de uitgangsstof ontzettend.
Zoals bij de meeste organische disulfiden is het centrale deel van het molecuul niet vlak: het C-S-S-C-deel van het molecuul heeft een tweevlakshoek van ongeveer 85°.
Reacties
Ph2S2 wordt in de organische synthese vooral gebruikt als bron voor de PhS-substituent.[3] Een goed voorbeeld in dit geval wordt gevormd door de synthese van PhS-gesubstitueerde carbonylverbindingen via het enolaat:
- RC(O)CHLiR’ + Ph2S2 → RC(O)CH(SPh)R’ + LiSPh
Reductie
Ph2S2 wordt gereduceerd door alkalimetalen, een standaard reactie voor disulfiden:
Met hydride-reagentia als natriumboorhydride en superhydride treden vergelijkbare reacties op. De zouten PhSM zijn een bron van krachtige nucleofielen: PhS−. Met de meeste alkylhalogeniden (RX)reageren deze stoffen tot thio-ethers met de algemene formule RSPh. Protoneren leidt uiteraard tot thiofenol:
- PhSM + HCl → HSPh + MCl
Chloreren
Ph2S2 reageert met chloor tot PhSCl (Zincke-disulfide-splitsing). Het zuiver isoleren van de stof is lastig, meestal vindt de synthese in situ plaats.
Catalysator voor de foto-isomerisatie van elkenen
Ph2S2 katalyseert de cis-trans isomerisatie van alkenen onder UV-bestraling.[4]
Oxidatie
De oxidatie van Ph2S2 met Pb(OAc)4 in methanol geeft de sulfinietester PhS(O)OMe.[5]
Bronnen, noten en/of referenties
|

