Cupraat
Cupraten (van Latijn cuprum = koper[1]) zijn chemische verbindingen (zouten) die koper bevatten en waarin het koper-atoom het centrale atoom is in een verder negatief geladen samengesteld ion.
Gebruik
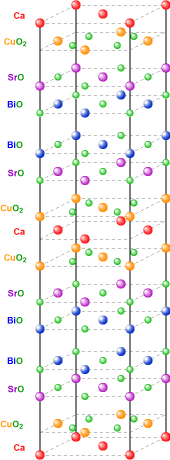
Cupraten zijn al eeuwenlang bekend en worden gebruikt in de organische en anorganische chemie. Nochtans is de interesse erin beduidend gestegen sinds 1986 na de ontdekking van supergeleiding op relatief hoge temperatuur in een lanthaan-barium-koperoxide door Georg Bednorz en Alex Müller. Meer dan 100.000 wetenschappelijke documenten werden gepubliceerd over supergeleiding in cupraten tussen 1986 en 2001. Bednorz en Müller wonnen de Nobelprijs voor Fysica slechts een jaar na hun ontdekking. Vanaf 1986 tot 2008, waren bijna alle bekende hoge temperatuur supergeleiders; cupraatsupergeleiders.
Terminologie
Wanneer een verbinding koper bevat in zijn hoogste oxidatietoestand in een complex ion dat een negatieve lading heeft, dan wordt het een "cupraat" genoemd, bijvoorbeeld; amminepentachloorcupraat(II) [NH3CuCl5]2−. Tetra-amminedichloorkoper(II) (NH3)4CuCl2 heeft een neutrale lading en is dus geen cupraation, maar een complex.
Wanneer het koperatoom in een complex anion een oxidatiegetal 1+ bezit spreekt men soms niet van cupraten maar van cuprieten, hoewel men ook wel de aanduiding cupraat(I) gebruikt. De naam cupriet wordt namelijk ook gebruikt voor een mineraal dat een koperoxide is en niet een zout. De term cupraat verwijst meestal naar de 2+ oxidatietoestand (II), maar soms kunnen ook hogere oxidatiegetallen ermee aangeduid worden. In de cupraatsupergeleiders is er meestal sprake van deels koper(II) en deels koper(III).
Anorganische cupraten
.png)
Cupraatanionen vormen complexe negatief geladen ionen met liganden zoals cyaniden, hydroxiden of halogeniden. Typische voorbeelden van deze complexen zijn tetracyanocupraat(I) [Cu(CN)4]3−, tetrachlorocupraat(II) [CuCl4]2− en hexahydroxidecupraat(II) [Cu(OH)6]4−. Er zijn ook zeldzame koper(III) en koper(IV) complexen zoals hexafluoridecupraat(III) [CuF6]3− of hexafluoridecupraat(IV) [CuF6]2−, die sterk oxiderende reagentia zijn. Terwijl tetracyanocupraat(I) [Cu(CN)4]3− kleurloos is, zijn de meeste andere koper(I) complexen roodbruin; koper(II) complexen hebben een intense turkooise blauwe kleur terwijl koper(III) en koper(IV) complexen oranje-rood zijn. Dilithium tetrachlorocupraat (Li2CuCl4) is een efficiënte katalysator voor de koppelingen van alkyl halogeniden in de Grignard reactie. Het wordt bereid door lithiumchloride (LiCl) en koper(II)chloride (CuCl2) in tetrahydrofuraan te mengen. Koper II oxide lost lichtjes op in geconcentreerde alkali om de overeenkomstige cupraat zouten te vormen (X= alkali metaal):
- 3 XOH + CuO + H2O → X3[Cu(OH)6]
Organische cupraten
.png)
Cupraten spelen een grote rol in de organische chemie. De eerste organische koperverbinding, het explosieve koper(I)acetylide Cu2C2, werd door Rudolf Christian Böttger in 1859 bereid.
Organische cupraten bevatten gewoonlijk een groep R2Cu, waarbij R een koolstof bevattende eenheid is. Ze reageren met zuurstof en water en vormen daarbij koper(I)oxide; zij zijn over het algemeen onoplosbaar in inerte oplosmiddelen, ze hebben de neiging om onstabiel te zijn bij bepaalde temperaturen en ze zijn moeilijk te hanteren. Niettemin, worden organische koperreagentia vaak in organische chemie gebruikt als alkylatiereagentia die ter plaatse in een inert milieu worden bereid.

Literatuurverwijzingen
|