Berylliumsulfaat
Berylliumsulfaat is een extreem giftige anorganische verbinding van beryllium, met als brutoformule BeSO4. De zuivere stof komt voor als een kleurloos kristallijn poeder, dat zeer goed oplosbaar is in water.
Berylliumsulfaat
| |||||
| Structuurformule en molecuulmodel | |||||
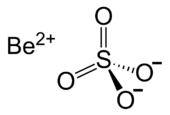 | |||||
Structuurformule van berylliumsulfaat | |||||
 | |||||
Berylliumsulfaat-kristallen | |||||
| Algemeen | |||||
| Molecuulformule (uitleg) | BeSO4 | ||||
| IUPAC-naam | berylliumsulfaat | ||||
| Molmassa | 105,074782 g/mol | ||||
| SMILES | [Be+2].[O-]S(=O)(=O)[O-] | ||||
| InChI | 1S/Be.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 | ||||
| CAS-nummer | 13510-49-1 | ||||
| EG-nummer | 236-842-2 | ||||
| PubChem | 26077 | ||||
| Beschrijving | Kleurloos kristallijn poeder | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H315 - H317 - H319 - H330 - H335 - H350 - H372 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P260 - P273 - P280 - P284 - P301+P310 | ||||
| VN-nummer | 1566 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | kleurloos | ||||
| Dichtheid | (watervrij) 2,50 g/cm³ (tetrahydraat) 1,71 g/cm³ | ||||
| Smeltpunt | (ontleedt) 580 °C | ||||
| Oplosbaarheid in water | (bij 30°C) 305 g/l | ||||
| Goed oplosbaar in | water | ||||
| Onoplosbaar in | ethanol | ||||
| Brekingsindex | 1,4374 (589 nm, 20 °C) | ||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
Berylliumsulfaat kan bereid worden door reactie van berylliumcarbonaat of berylliumhydroxide met zwavelzuur:
Eigenschappen
Van berylliumsulfaat zijn naast het watervrij zout ook meerdere hydraten bekend: het di-, mono- en commercieel verhandelde tetrahydraat. Deze hydraten verliezen door verhitting sequentieel hun kristalwater: het tetrahydraat gaat bij 111,5°C over naar het dihydraat, dat bij 158°C overgaat naar het monohydraat.[1] Daarnaast is ook een hexahydraat bekend, dat reeds bij 76°C overgaat naar het dihydraat. De watervrije stof kan bekomen worden door verhitting tot ongeveer 400°C. Dit zout is stabiel tot temperaturen rond 580°C. Watervrij berylliumsulfaat is - in tegenstelling tot zijn hydraten - zeer moeilijk oplosbaar in water.
Toepassingen
Berylliumsulfaat wordt gebruikt als lewiszuur en bij de synthese van andere berylliumverbindingen. Daarnaast werd het, in combinatie met radiumsulfaat, gebruikt als neutronenbron bij de ontdekking van kernsplijting.
Berylliumsulfaat wordt ook aangewend in de homeopathie.
Externe links
- (en) MSDS van berylliumsulfaat
- (en) Gegevens van Berylliumsulfaat in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|


