Benzeenselenol
Benzeenselenol is een organische verbinding van seleen, met als brutoformule C6H6Se. De stof komt voor als een kleurloze vloeistof met een zeer onaangename geur, die slecht oplosbaar is in water. Het behoort tot de stofklasse der selenolen en wordt vaak gebruikt bij de organische synthese van organoseleenverbindingen.
Benzeenselenol
| ||||
| Structuurformule en molecuulmodel | ||||
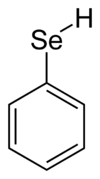 | ||||
Structuurformule van benzeenselenol | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H6Se | |||
| IUPAC-naam | benzeenselenol | |||
| Andere namen | selenofenol, selenylbenzeen | |||
| Molmassa | 156,0639 g/mol | |||
| SMILES | C1=CC=C(C=C1)[Se] | |||
| InChI | 1S/C6H5Se/c7-6-4-2-1-3-5-6/h1-5H | |||
| CAS-nummer | 645-96-5 | |||
| EG-nummer | 211-457-2 | |||
| PubChem | 6327608 | |||
| Beschrijving | Kleurloze vloeistof | |||
| Vergelijkbaar met | thiofenol | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,479 g/cm³ | |||
| Goed oplosbaar in | organische oplosmiddelen | |||
| Slecht oplosbaar in | water | |||
| Brekingsindex | 1,616 (589 nm, 20 °C) | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 1,1 D | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Benzeenselenol kan bereid worden door de reactie van fenylmagnesiumbromide met seleen in di-ethylether, gevolgd door afwerking met verdund waterstofbromide:[1]
 Synthese van benzeenselenol.
Synthese van benzeenselenol.
De allereerste synthese vond plaats door reactie van benzeen met seleentetrachloride, in aanwezigheid van aluminiumtrichloride.[2]
Eigenschappen en reacties
Benzeenselenol wordt gemakkelijk geoxideerd tot difenyldiselenide. De reden hiervoor is de zwakke binding tussen seleen een koolstof. De vorming van het diselenide wordt gekenmerkt door een gele kleur van het reactiemengsel. Het kan opnieuw worden omgezet in het selenol door reductie en aanzuren.
Benzeenselenol is - wegens een langere binding tussen waterstof en seleen - ongeveer 7 keer meer zuur dan het vergelijkbare zwavelanaloog thiofenol. Het overeenkomstige geconjugeerde base (C6H5Se−) is een zeer goed nucleofiel en kan gebruikt worden om organische seleniden te bereiden.[3] De reactie is zeer vergelijkbaar met de Williamson-ethersynthese voor alkoxiden.
Externe link
Bronnen, noten en/of referenties
|