Base (scheikunde)
Een base of loog – ook wel alkali genoemd – in oplossing heeft een pH-waarde hoger dan 7 en zal lakmoespapier blauw kleuren.
| ZUREN en BASEN |
|---|
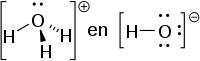 |
| Algemene begrippen |
| pH Zuur-basereactie Zuur-basetitratie Zuurconstante Buffer Waterevenwicht Hammett-zuurfunctie |
| Zuren |
|
Sterk · Zwak · Lewiszuur · Anorganisch zuur · Organisch zuur · Superzuur · Oxozuur · Halogeenzuurstofzuur |
| Basen |
|
Sterk · Zwak · Lewisbase · Organische base |
| Portaal |
Een base is de tegenhanger van een zuur. Zuren worden door basen geneutraliseerd onder vorming van een zout en water. Zwakke basen, zoals aluminiumhydroxide, kunnen gebruikt worden voor het tijdelijk neutraliseren van het maagzuur. Sterke basen zijn even gevaarlijk of nog gevaarlijker dan sterke zuren en veroorzaken ernstige weefselbeschadiging. Een voorbeeld van een sterke base is natronloog.
Definities
Een base kan op drie manieren gedefinieerd worden:
- volgens Arrhenius
- volgens Brønsted en Lowry
- volgens Lewis
Volgens Arrhenius
Een base volgens Arrhenius (een Arrhenius-base) is een molecuul dat in water (H2O) aanleiding geeft tot het vormen van een hydroxide-ion (OH−). Het molecuul kan ook zelf een hydroxide-ion bevatten, maar dat hoeft niet. Twee voorbeelden van Arrhenius-basen zijn natriumhydroxide (NaOH) en ammoniak (NH3):
NaOH → Na+ + OH−
NH3 + H2O → NH4+ + OH−
Volgens Brønsted en Lowry
Een base volgens Johannes Nicolaus Brønsted en Thomas Lowry is een molecuul of negatief geladen ion dat waterstofionen (H+) kan opnemen en wordt een Brønsted-base genoemd. Deze twee chemici kwamen in 1923 tegelijkertijd, maar onafhankelijk van elkaar met deze definitie. Vaak wordt echter alleen de naam van Brønsted vermeld. Elke Arrhenius-base is ook een Brønsted-base, maar dat geldt niet omgekeerd. Volgens Arrhenius moet het molecuul namelijk opgelost worden in water. Dit is volgens de definitie van Brønsted en Lowry echter niet noodzakelijk.
Volgens Lewis
Een base volgens Lewis is een molecuul met een vrij elektronenpaar (:) en wordt een lewisbase genoemd. Het elektronenpaar kan met een zuur gedeeld worden, bijvoorbeeld:
BF3 (zuur) + :NH3 (base) → F3B:NH3
Alle brønstedbasen zijn ook lewisbasen, maar het omgekeerde geldt niet altijd.
Naamgeving
Naamgeving van de metaalhydroxiden: naam van het metaal + hydroxide.
Voorbeelden hiervan zijn:
- natriumhydroxide (NaOH) (een oplossing van natriumhydroxide in water wordt natronloog genoemd)
- kaliumhydroxide (KOH) (een oplossing van kaliumhydroxide in water wordt kaliloog genoemd)
- bariumhydroxide (Ba(OH)2) (een oplossing van bariumhydroxide in water wordt barietwater genoemd)
- calciumhydroxide (Ca(OH)2) (een oplossing van calciumhydroxide in water wordt kalkwater genoemd)
Ook hoeft een basische stof niet per se een hydroxide te zijn, ook (an)organische moleculen of ionen kunnen basisch reageren.
- ammoniak (NH3)
- natriumcarbonaat Na2CO3
- ureum
- guanidinium
- Oxiden, zoals koper(II)oxide
- Hexametyleentetramine ofwel hexamine
- Andere organische aminen
Voeding
In de wereld omtrent natuurvoeding wordt onder andere uitgegaan van een balans tussen base en zuur in een lichaam, en daarmee een evenwicht tussen zuurvormend en basischvormend voedsel. Tot zeer basische voedingsmiddelen behoren grofweg vele groenten, kraanwater, kruidenthee (tegenover zeer verzurende onder meer: zoetstoffen, en grofweg bewerkte voedingsmiddelen, kant-en-klare voeding, en verpakt of ingeblikt voedsel).[1]
Referenties
- Zuur-base voedingslijst (pdf), Stichting Zuur-Base Kennis. Geraadpleegd 13 februari 2020.
| Zoek base op in het WikiWoordenboek. |
| Zie de categorie Bases van Wikimedia Commons voor mediabestanden over dit onderwerp. |