Ammoniumthiocyanaat
Ammoniumthiocyanaat is een anorganische verbinding met als brutoformule NH4SCN. Het is het zout van ammoniak en thiocyaanzuur. In oudere boeken en publicaties wordt de verbinding ook wel als ammoniumr(h)odanide aangeduid.
Ammoniumthiocyanaat
| ||||
| Structuurformule en molecuulmodel | ||||
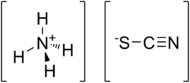 | ||||
Structuurformule van ammoniumthiocyanaat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | NH4SCN | |||
| IUPAC-naam | ammoniumthiocyanaat | |||
| Andere namen | ammoniumrhodanide | |||
| Molmassa | 76,12086 g/mol | |||
| SMILES | C(#N)[S-].[NH4+] | |||
| InChI | 1S/CHNS.H3N/c2-1-3;/h3H;1H3 | |||
| CAS-nummer | 1762-95-4 | |||
| PubChem | 15666 | |||
| Beschrijving | Kleurloze, hygroscopische kristallijne vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H312 - H332 - H412 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P280 | |||
| Hygroscopisch? | ja | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,305 g/cm³ | |||
| Smeltpunt | 149,5 °C | |||
| Kookpunt | (ontleedt) 170 °C | |||
| Oplosbaarheid in water | 1280 g/l | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
De belangrijkste bereidingsroute verloopt via de reactie van koolstofdisulfide met een waterige ammoniak-oplossing. Als intermediair treedt ammoniumdithiocarbamaat op, dat bij verwarmen ontleedt in ammoniumthiocyanaat en waterstofsulfide:
Reacties
Ammoniumthiocyanaat is in lucht stabiel, bij verwarmen isomeriseert het tot thio-ureum, net zoals het zuurstofanaloog ammoniumcyanaat tot ureum isomeriseert:
Er ontstaat een evenwichtsmengsel: bij 150 °C 30,3% en bij 180 °C 25,3% thio-ureum. Boven 200 °C ontleed het poeder in ammoniak, waterstofsulfide en koolstofdisulfide, het residu bestaat uit guanidinethiocyanaat.
Een oplossing van ammoniumthiocyanaat reageert zwak zuur, met natronloog en kaliloog worden respectievelijk natrium- en kaliumthiocyanaat gevormd. Met ijzer(III)-zouten wordt het in de kwalitatieve analyse bekende diep rode Fe(SCN)63−- complex gevormd:
Ammoniumthiocyanaat reageert met diverse metaalionen, waaronder koper, zilver, zink, lood en kwik. Bij deze reacties ontstaan neerslagen van de onoplosbare thiocyanaatzouten, die wel weer oplosbaar zijn in organische oplosmiddelen.
Toepassingen
Ammoniumthiocyanaat wordt toegepast bij de synthese van herbiciden, thio-ureum, en transparante harsen. Het zit verwerkt in lucifers en dient als stabilisator in de fotografie. Verder is het een component in een aantal anti-roestproducten. Ammoniumthiocyanaat wordt gebruikt als voorbehandelingsmiddel bij textielverven, als een tracer bij de exploitatie van olievelden en bij de scheiding van hafnium van zirconium. De reactie met ijzer(III)-ionen tot een gekleurd complex wordt gebruikt in de analytische scheikunde bij complexeometrische titraties als indicator.
Externe links
- (en) MSDS van ammoniumthiocyanaat
- (en) Gegevens van Ammoniumthiocyanaat in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|

