2,6-dimethylnaftaleen
2,6-dimethylnaftaleen (2,6-DMN) is een polycyclische aromatische koolwaterstof. Het is een van de vele mogelijke dimethylnaftaleen-isomeren, die afgeleid zijn van naftaleen door daarop twee methylgroepen te substitueren. 2,6-DMN is van commercieel belang als uitgangsproduct voor hoogperformante polyestervezels en -films.
2,6-dimethylnaftaleen
| ||||
| Structuurformule en molecuulmodel | ||||
 | ||||
Structuurformule van 2,6-dimethylnaftaleen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C12H12 | |||
| IUPAC-naam | 2,6-dimethylnaftaleen | |||
| Molmassa | 156,22 g/mol | |||
| SMILES | CC1=CC2=C(C=C1)C=C(C=C2)C | |||
| CAS-nummer | 581-42-0 | |||
| PubChem | 11387 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H410 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P501 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | beige | |||
| Smeltpunt | 106-110 °C | |||
| Kookpunt | 262 °C | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
| Gealkyleerde naftalenen (methyl-, dimethyl- en polymethylnaftalenen, waaronder dus ook 2,6-DMN) komen in lage concentraties voor in ruwe aardolie en steenkoolteer. De afscheiding eruit is moeilijk en duur; ze vereist een aantal eenheidsbewerkingen zoals selectieve adsorptie en kristallisatie, naast eventueel isomerisatiereacties om het gehalte van 2,6-DMN te verhogen.[1] Er is daarom gezocht naar syntheseroutes van 2,6-DMN uitgaande van geschikte en liefst goedkope verbindingen. Enkele daarvan zijn: |
|
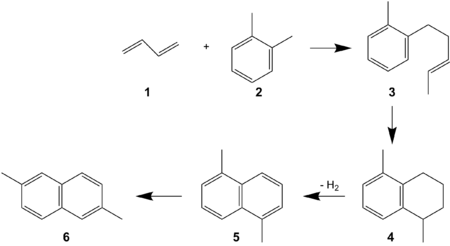 |
|
Toepassingen
2,6-dimethylnaftaleen wordt gebruikt voor de vorming van 2,6-naftaleendicarbonzuur door oxidatie van 2,6-dimethylnaftaleen in vloeibare fase. 2,6-Naftaleendicarbonzuur is een monomeer voor de productie van hoogperformante polymeren, in het bijzonder poly(ethyleen-2,6-naftaleendicarboxylaat) of korter polyethyleennaftalaat (PEN), een polyester dat sterker is en een hogere thermische weerstand heeft dan het veelgebruikte pet. 2,6-DMN is echter duurder dan tereftaalzuur dat voor pet wordt gebruikt.
