1,1-difluorethaan
De organische fluorverbinding 1,1-difluorethaan (R 152a of HFK-152a) is een halogeenalkaan die behoort tot de fluorkoolwaterstoffen. Het is een kleurloos gas. Het is een isomeer van 1,2-difluorethaan (HFK-152).
1,1-difluorethaan
| ||||
| Structuurformule en molecuulmodel | ||||
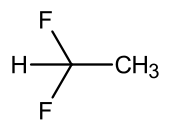 | ||||
Structuurformule van 1,1-difluorethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2H4F2 | |||
| IUPAC-naam | 1,1-difluorethaan | |||
| Andere namen | R 152a; HFC-152a; HFK-152a; ethylideendifluoride; ethylideenfluoride | |||
| Molmassa | 66,05 g/mol | |||
| SMILES | CC(F)F | |||
| InChI | 1S/C2H4F2/c1-2(3)4/h2H,1H3 | |||
| CAS-nummer | 75-37-6 | |||
| EG-nummer | 200-866-1 | |||
| PubChem | 6368 | |||
| Beschrijving | kleurloos gas met zwakke zoete geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220 - H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P377 - P381 - P410+P403 | |||
| VN-nummer | 1030 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gas | |||
| Kleur | kleurloos | |||
| Dichtheid | (vloeibare fase bij kookpunt) 1,012 g/cm³ | |||
| Smeltpunt | −117 °C | |||
| Kookpunt | −25 °C | |||
| Dampdruk | (20°C) 601.000 Pa | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Productie
1,1-Difluorethaan wordt gevormd door de additie van waterstoffluoride (HF) aan acetyleen. Hiervoor is een katalysator nodig, gewoonlijk boortrifluoride (BF3) of BF3 in combinatie met tin(IV)chloride (SnCl4) als co-katalysator.[1]
Een alternatieve methode is de reactie van chlooretheen met waterstoffluoride. Hiervoor is ook een katalysatorsysteem nodig bestaande uit een tin(IV)verbinding zoals tin(IV)chloride en een alkalimetaalhalide zoals natriumchloride.[2]
Eigenschappen
Het is een zeer licht ontvlambaar gas en kan in lucht explosieve mengsels maken bij concentraties tussen circa 4 en 19 %.
De kritische temperatuur is 113,5 °C en de kritische druk is 44,9 bar. Het gas is 2,34 keer zwaarder dan lucht.[3]
Het is geen ozonlaag afbrekende stof. Het aardopwarmingsvermogen is vrij laag: 124 (het laagste onder de fluorkoolwaterstoffen).
Toepassingen
De voornaamste toepassingen van 1,1-difluorethaan zijn: drijfgas in spuitbussen; component van koudemiddelen; blaasmiddel voor polystyreenschuimen.[4]
Uitgaande van 1,1-difluorethaan kan 1,1-difluoretheen bereid worden; dit kan door eerst 1,1-difluorethaan te chloreren tot 1-chloor-1,1-difluorethaan en dat door pyrolyse te splitsen in 1,1-difluoretheen en HCl.[5]
1,1-Difluorethaan kan ook omgezet worden in vinylfluoride door afsplitsing van HF of door reactie met acetyleen.[6]
Externe links
- (en) Gegevens van 1,1-difluorethaan in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
- Air Liquide Gas Encyclopaedia

