Trichloortrifluorethaan
Trichloortrifluorethaan is een halogeenalkaan met als brutoformule C2Cl3F3. Het is een kleurloze, vluchtige vloeistof met een kenmerkende geur, en is goed oplosbaar in water.
Trichloortrifluorethaan
| ||||
| Structuurformule en molecuulmodel | ||||
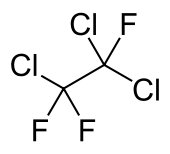 | ||||
Structuurformule van trichloortrifluorethaan | ||||
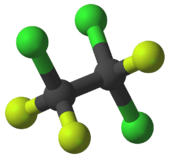 | ||||
Molecuulmodel van trichloortrifluorethaan | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C2Cl3F3 | |||
| IUPAC-naam | 1,1,2-trichloor-1,2,2-trifluorethaan | |||
| Andere namen | CFC-113, Freon 113, Frigen 113 TR | |||
| Molmassa | 187,376 g/mol | |||
| SMILES | C(C(F)(Cl)Cl)(F)(F)Cl | |||
| CAS-nummer | 76-13-1 | |||
| Beschrijving | Kleurloze vloeistof met kenmerkende geur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H411 - H420 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,56 g/cm³ | |||
| Smeltpunt | −35 °C | |||
| Kookpunt | 47,7 °C | |||
| Zelfontbrandings- temperatuur | 680 °C | |||
| Dampdruk | 36.000 Pa | |||
| Oplosbaarheid in water | 17 g/l | |||
| Goed oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Toepassingen
De stof werd oorspronkelijk gebruikt als oplosmiddel, als drijfgas in spuitbussen en als koelmiddel in koelkasten en diepvriezers, vanwege het relatief lage kookpunt en chemische inertheid. Vandaag de dag is het koelmiddel verboden wegens te grote schade aan het milieu.
Effecten op het milieu
Trichloortrifluorethaan heeft zeer negatieve effecten op het milieu, in het bijzonder op waterorganismen en op de ozonconcentratie in de atmosfeer. Doordat heel wat van de stof in de atmosfeer terechtkomt, reageert deze met ultraviolet licht. De stof wordt hierdoor afgebroken:
Het hierbij vrijgekomen chloor-radicaal breekt de ozon af:
Toxicologie en veiligheid
Bij contact met een heet oppervlak of met een vlam ontleedt deze stof onder vorming van giftige en corrosieve gassen (waterstofchloride, fosgeen, waterstoffluoride en carbonylfluoride). Ze reageert hevig met metalen in poedervorm, met kans op brand en ontploffing. De stof tast ook magnesium en zijn legeringen aan.

