Thymolblauw
Thymolblauw of thymolsulfonftaleïne is een bruin-groen of rood-bruin kristallijn poeder dat wordt gebruikt als pH-indicator om bij een zuur-basetitratie het equivalentiepunt te bepalen. Het is slecht oplosbaar in water. Het omslaggebied ervan ligt tussen 1,2 en 2,8 (overgang van rood naar geel) en tussen 8,0 en 9,6 (overgang van geel naar blauw).
Thymolblauw
| ||||
| Structuurformule en molecuulmodel | ||||
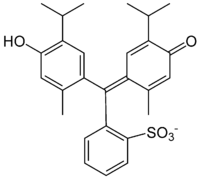 | ||||
Structuurformule van thymolblauw | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C27H30O5S | |||
| IUPAC-naam | 4-[9-(4-hydroxy-2-methyl-5-propaan-2-yl-fenyl)-7,7-dioxo-8-oxa-7λ6-thiabicyclo[4.3.0]nona-1,3,5-trien-9-yl]- 5-methyl-2-propaan-2-yl-fenol | |||
| Andere namen | α-hydroxy-α,α-bis(5-hydroxycarvacryl)-o-tolueensulfonzuur-γ-sultone, thymolsulfonftaleïne | |||
| Molmassa | 466,5891 g/mol | |||
| SMILES | c1cc2S(OC(c2cc1)(c1c(cc(c(c1)C(C)C)O)C)c1cc(c(cc1C)O)C(C)C)(=O)=O | |||
| CAS-nummer | 76-61-9 | |||
| PubChem | 65565 | |||
| Beschrijving | Bruin-groen of rood-bruin kristallijn poeder | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | bruin-groen of rood-bruin | |||
| Smeltpunt | 221-224 °C | |||
| Goed oplosbaar in | ethanol | |||
| Onoplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Als thymolblauw als indicator wordt toegepast in een titratie wordt de stof eerst opgelost in ethanol (ongeveer 1 gram per 100 ml), waarna van de verkregen oplossing 2 tot 4 druppels gebruikt worden per titratie. De verandering van de kleur van de indicator geeft het equivalentiepunt aan.
De structuurformule hiernaast geeft thymolblauw weer in het middengebied van de pH-schaal (2,8 - 8,0)
In sterk zuur milieu (pH < 1,2) zal de ketonfunctie in de rechter cyclohexidieenring geprotoneerd worden. De zesring aromatiseert, waardoor het centrale koolstofatoom een sulton vormt met de sulfonaatgroep aan de onderste aromaatring. De overgang van sp3-hybridisatie van het centrale koolstofatoom heeft als consequentie het verbreken van de conjugatie tussen de verschillende aromatische ringen. De energie-afstand tussen de hoogst bezette HOMO en de laagste vrije orbitaal LUMO verandert.
In sterk basisch milieu zal ook de fenolgroep aan de linker benzeenring gedeprotoneerd worden. De ontstane negatieve lading kan over het hele aromatische systeem verdeeld worden. Opnieuw verandert de energie-afstand tussen de hoogst bezette (HOMO) en de laagste vrije orbitaal (LUMO).