Sulfanilzuur
Sulfanilzuur is de triviale naam van 4-aminobenzeensulfonzuur, een organische verbinding met als brutoformule C6H7NO3S. Het kan opgevat worden als een sulfonzuur van aniline. De stof komt voor als een witte tot grijze kristallijne vaste stof, die slecht oplosbaar is in water.
Sulfanilzuur
| ||||
| Structuurformule en molecuulmodel | ||||
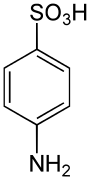 | ||||
Structuurformule van sulfanilzuur | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C6H7NO3S | |||
| IUPAC-naam | 4-aminobenzeensulfonzuur | |||
| Andere namen | aniline-p-sulfonzuur | |||
| Molmassa | 173,2 g/mol | |||
| SMILES | C1=CC(=CC=C1N)S(=O)(=O)O | |||
| InChI | 1S/C6H7NO3S/c7-5-1-3-6(4-2-5)11(8,9)10/h1-4H,7H2,(H,8,9,10) | |||
| CAS-nummer | 121-57-3 | |||
| EG-nummer | 204-482-5 | |||
| PubChem | 8479 | |||
| Beschrijving | Witte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H317 - H319 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 | |||
| EG-Index-nummer | 612-014-00-X | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,485 g/cm³ | |||
| Smeltpunt | (ontleedt) ca. 288 °C | |||
| Oplosbaarheid in water | (bij 20°C) 10 g/l | |||
| Slecht oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Sulfanilzuur wordt bereid door zwavelzuur met aniline te verhitten tot 190°C. Dan wordt in een elektrofiele substitutiereactie een waterstofatoom in de benzeenring vervangen door een sulfonzure functionele groep.
Isomerie
Sulfanilzuur is een van drie isomeren van aminobenzeensulfonzuur. De andere zijn:
- orthanilzuur (2-aminobenzeensulfonzuur)
- metanilzuur (3-aminobenzeensulfonzuur)
Toepassingen
Sulfanilzuur is een belangrijk intermediair product in de kleurstoffenindustrie. Het wordt vooral gebruikt voor de productie van optische witmakers die worden aangebracht op papier of textiel, en verwerkt in wasmiddelen en zeep; daarnaast ook voor kleurstoffen voor levensmiddelen, speciale verfstoffen en additieven voor beton.
Toxicologie en veiligheid
Sulfanilzuur is irriterend voor de ogen en de huid. Langdurige of herhaaldelijk contact kan de huid gevoelig maken.
Het is een brandbare stof: bij verbranding komen giftige dampen vrij van o.a. stikstofoxiden en zwaveloxiden.
