Ruthenium(VIII)oxide
Ruthenium(VIII)oxide (RuO4) is een goudgele vaste stof die vooral in de elektronenmicroscopie vrij regelmatig wordt toegepast om preparaten te kleuren.
Ruthenium(VIII)oxide
| ||||
| Structuurformule en molecuulmodel | ||||
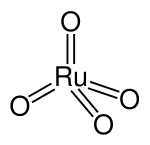 | ||||
Structuurformule van ruthenium(VIII)oxide | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | RuO4 | |||
| IUPAC-naam | ruthenium(VIII)oxide | |||
| Molmassa | 165,0676 g/mol | |||
| SMILES | O=[Ru](=O)(=O)=O | |||
| InChI | 1S/4O.Ru | |||
| CAS-nummer | 20427-56-9 | |||
| EG-nummer | 243-813-8 | |||
| PubChem | 119079 | |||
| Beschrijving | Goudgeel poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H272 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P220 - P261 - P305+P351+P338 | |||
| Opslag | Bewaren bij 2-8°C, afgesloten van het licht | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | goudgeel | |||
| Dichtheid | 3,29 g/cm³ | |||
| Smeltpunt | 25,4 °C | |||
| Kookpunt | 40 °C | |||
| Goed oplosbaar in | chloroform, tetrachloormethaan | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Ruthenium(VIII)oxide kan bereid worden door oxidatie van ruthenium(III)chloride met natriumperjodaat:
Toepassingen
Het kleuren van elektronenmicroscopische preparaten heeft niet te maken met kleuren maar zorgt voor een beter contrast. Een ander veel hiervoor gebruikte verbinding is osmium(VIII)oxide, maar ruthenium(VIII)oxide is reactiever. Er zijn bijvoorbeeld polymeren die wel door ruthenium en niet door osmium ingekleurd (gestained) worden.
Toxicologie en veiligheid
Ruthenium(VIII)oxide is een vrij gevaarlijk materiaal: als achtwaardige ruthenium-verbinding is het een extreem sterke oxidator. Dit betekent dat het met grote omzichtigheid gebruikt moet worden. Het gas reageert namelijk met ieder organisch materiaal, de hoornvliezen daarbij inbegrepen en dat kan tot permanente beschadiging van de ogen leiden. Ruthenium gaat daarbij namelijk in een lagere oxidatietoestand over en aangezien deze vormen niet meer gasvormig zijn kleurt het neergeslagen metaal de meeste voorwerpen waar het mee in aanraking komt zwart.

