Osmotische druk
Osmotische druk (osmotische potentiaal) is het drukverschil dat tussen twee oplossingen van verschillende concentraties ontstaat ten gevolge van osmose. Met de term osmotische waarde van een enkele oplossing wordt de osmotische druk aangeduid ten opzichte van het zuivere oplosmiddel.
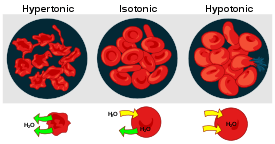
Osmotische drukverschillen bij rode bloedcellen
De osmotische druk is voor verdunde oplossingen:
Hierbij is:
de osmotische druk in Pascal de van 't Hoff-factor de concentratie van de oplossing (of het concentratieverschil), gegeven in mol·m−3. de gasconstante (ca. 8,3144 J·mol−1·K−1) de absolute temperatuur in K
Het doet er hierbij niet toe wat er is opgelost, wel is het aantal opgeloste deeltjes belangrijk. Voor een 1 mol/liter oplossing van natriumchloride geldt dat M=2000 (1000 mol/m3 Na+-ionen en 1000 mol/m3 Cl−-ionen).
Als de osmostische druk de kans wordt gegeven, kan een evenwichtsdruk (hoogteverschil) worden opgebouwd tussen twee oplossingen van verschillende concentraties:
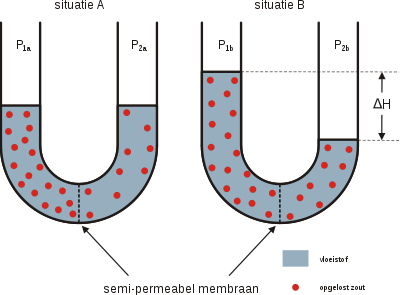 |
- P = Druk [Pa]
- ΔH = Hoogteverschil [m]
- ρ = Dichtheid [kg m−3]
- g = gravitatie [m s−2]
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.