Wet van Raoult
De wet van Raoult is genoemd naar de Franse scheikundige François-Marie Raoult (1830-1901) en stelt dat voor een ideaal mengsel de partiële druk van component in de gasfase gelijk is aan de molfractie (molaire breuk) van component in de vloeistoffase maal de verzadigde dampspanning.
- ,
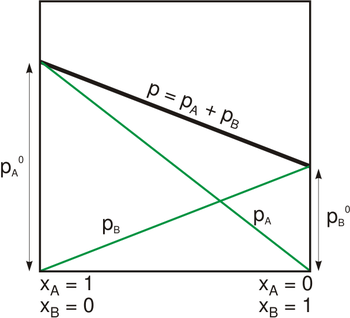
Dampspanning van een binair mengsel dat de wet van Raoult volgt. De zwarte lijn geeft de totale dampdruk weer als functie van de molfractie van component B, en de twee groene rechten geven de partieeldrukken weer van de twee componenten.
met
- de verzadigde dampspanning van de zuivere component [Pa]
- de partiële druk van component [Pa]
- de molfractie component in de vloeistoffase [-]
De wet van Raoult geldt in het algemeen slechts voor verdunde oplossingen.
Raoult stelde zijn wet op op grond van onderzoekingen in de jaren 1887 en 1888.
Deze wet vormt samen met de wet van Dalton de basis voor destillatie berekeningen en samen met de wet van Henry voor de beschrijving van niet-ideale oplossingen. Een praktische toepassing van de wet is een ontgasser.
This article is issued from
Wikipedia.
The text is licensed under Creative
Commons - Attribution - Sharealike.
Additional terms may apply for the media files.