Magnesiumperchloraat
Magnesiumperchloraat is het magnesiumzout van perchloorzuur, met als brutoformule Mg(ClO4)2. De stof komt voor als een wit hygroscopisch poeder, dat zeer goed oplosbaar is in water. In tegenstelling tot veel andere zouten (ammoniumnitraat, natriumchloride) is de oplosreactie in water zelfs exotherm: het maken van een verdunning moet gebeuren met kleine hoeveelheden tegelijk, de geconcentreerde magnesiumperchloraat-oplossing wordt druppelsgewijs met een druppeltrechter aan meer water toegevoegd.
Magnesiumperchloraat
| ||||
| Structuurformule en molecuulmodel | ||||
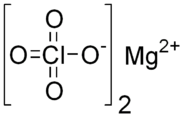 | ||||
Structuurformule van magnesiumperchloraat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | Mg(ClO4)2 | |||
| IUPAC-naam | magnesiumdiperchloraat | |||
| Molmassa | 223,2062 g/mol | |||
| SMILES | [O-]Cl(=O)(=O)=O.[O-]Cl(=O)(=O)=O.[Mg+2] | |||
| InChI | 1S/2ClHO4.Mg/c2*2-1(3,4)5;/h2*(H,2,3,4,5);/q;;+2/p-2 | |||
| CAS-nummer | 10034-81-8 | |||
| EG-nummer | 233-108-3 | |||
| PubChem | 24840 | |||
| Beschrijving | Wit poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H272 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P220 - P261 - P305+P351+P338 | |||
| Hygroscopisch? | ja | |||
| VN-nummer | 1475 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 2,21 g/cm³ | |||
| Smeltpunt | 251 °C | |||
| Oplosbaarheid in water | 993 g/l | |||
| Goed oplosbaar in | water, ethanol | |||
| Thermodynamische eigenschappen | ||||
| ΔfH | −568,90 kJ/mol | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Eigenschappen en reacties
Magnesiumperchloraat is sterke oxidator. In contact met brandbare verbindingen vormt het explosieve mengsels. Deze mengsels zijn erg schokgevoelig en kunnen zelf bij het bereiden detoneren. Bij het verhitten ontstaat zuurstofgas.
Magnesiumperchloraat is tevens uiterst hygroscopisch, maar aangezien het exotherm reageert met water, moet het steeds zo droog mogelijk bewaard worden.
Toepassingen
Magnesiumperchloraat werd vroeger gebruikt als droogmiddel om niet-oxideerbare gas- of luchtmonsters te drogen, maar dat wordt tegenwoordig nauwelijks nog gedaan wegens de gevaren die aan het gebruik van perchloraten zijn verbonden.

