Kaliumwaterstofcarbonaat
Kaliumwaterstofcarbonaat of kaliumbicarbonaat is een kaliumzout van diwaterstofcarbonaat, met als brutoformule KHCO3. De stof komt voor als een wit poeder of als kleurloze kristallijne vaste stof en is zeer goed oplosbaar in water.
Kaliumwaterstofcarbonaat
| ||||
| Structuurformule en molecuulmodel | ||||
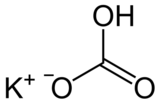 | ||||
Structuurformule van kaliumwaterstofcarbonaat | ||||
Kaliumwaterstofcarbonaat-kristallen | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | KHCO3 | |||
| IUPAC-naam | kaliumwaterstofcarbonaat | |||
| Andere namen | kaliumbicarbonaat, zuur kaliumcarbonaat | |||
| Molmassa | 100,11 g/mol | |||
| CAS-nummer | 298-14-6 | |||
| EG-nummer | 206-059-0 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit of kleurloos | |||
| Dichtheid | 2,17 g/cm³ | |||
| Smeltpunt | (ontleedt) 100 °C | |||
| Oplosbaarheid in water | (bij 20°C) 333 g/l | |||
| Goed oplosbaar in | water | |||
| Onoplosbaar in | ethanol | |||
| Nutritionele eigenschappen | ||||
| E-nummer | E501 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Kaliumwaterstofcarbonaat wordt bereid door het oplossen van kaliumcarbonaat in water, onder toevoegen van koolstofdioxide:
Toepassingen
Kaliumwaterstofcarbonaat wordt gebruikt als voedingsadditief, en heeft hetzelfde E-nummer als kaliumcarbonaat: E501. Het wordt gebruikt als zuurteregelaar, bijvoorbeeld voor het ontzuren van wijn of bier, en als stabilisator van vooral cacaoproducten. Kaliumwaterstofcarbonaat is het rijsmiddel in bakpoeder: bij verhitten vormt het kaliumcarbonaat, waarbij waterdamp en koolstofdioxide vrijkomen, die het bakdeeg doen rijzen:
De Europese Commissie heeft kaliumwaterstofcarbonaat op 6 mei 2008 toegelaten als gewasbeschermingsmiddel in de land- en tuinbouw.[1] In Nederland heeft de stof een toelating als insecticide ter bestrijding van perenbladvlo in de teelt van peren en als fungicide ter bestrijding van schurft in de teelt van appels, ter bestrijding van echte meeldauw en vruchtrot in wijndruiven en ter bestrijding van echte meeldauw in de teelt van aardbeien, bessen, bramen, frambozen en rozen.
De stof wordt ook gebruikt in bluspoeders geschikt voor het bestrijden van branden van brandklasse B of C. Het heeft een grotere bluskracht dan natriumbicarbonaat.[2]
Externe links
| Bronnen, noten en/of referenties |