IJzer(III)fluoride
IJzer(III)fluoride is een ijzerzout van waterstoffluoride, met als brutoformule FeF3. De stof komt voor als een witte hygroscopische vaste stof met een trigonale kristalstructuur. IJzer(III)fluoride is matig tot goed oplosbaar in water. Het komt ook voor als trihydraat, dat lichtpaars gekleurd is.
IJzer(III)fluoride
| ||||
| Structuurformule en molecuulmodel | ||||
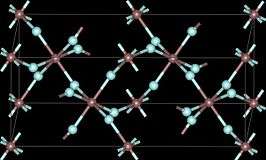 | ||||
Kristalstructuur van ijzer(III)fluoride | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | FeF3 | |||
| IUPAC-naam | ijzer(III)fluoride | |||
| Andere namen | ijzertrifluoride | |||
| Molmassa | 112,84021 g/mol | |||
| SMILES | F[Fe](F)F | |||
| InChI | 1S/3FH.Fe/h3*1H;/q;;;+3/p-3 | |||
| CAS-nummer | 7783-50-8 | |||
| EG-nummer | 232-002-4 | |||
| PubChem | 24552 | |||
| Beschrijving | Witte vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H312 - H314 - H332 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Hygroscopisch? | ja | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 3,87 g/cm³ | |||
| Smeltpunt | > 1000 °C | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | trigonaal | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
IJzer(III)fluoride is corrosief en zeer schadelijk voor het milieu.
Toepassingen
IJzer(III)fluoride is een lewiszuur en deze eigenschap wordt in talrijke katalytische processen toegepast. Een voorbeeld hiervan is de koppelingsreactie van biarylverbindingen, die normaal gezien door transitiemetalen wordt gekatalyseerd. Biarylen zijn belangrijke precursors in verscheidene andere organische reacties, wat hun synthese belangrijk maakt. Deze moet dan ook efficiënt verlopen. De meeste koppelingsreacties gebruiken palladium of nikkel als katalysator, om zelfkoppeling te voorkomen. Echter, sommige koppelingsreacties, waaronder die van biarylen, kunnen door ijzer(III)fluoride (trihydraat) gekatalyseerd worden. Aangenomen wordt dat de fluorideliganden verhinderen dat een teveel aan arylliganden zou coördineren met ijzer.

