Autokatalyse
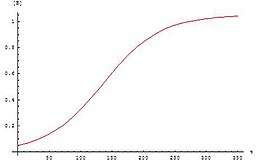
Bij autokatalyse wordt een chemische reactie versterkt door het product van diezelfde reactie. Omdat er aan het begin van een dergelijke autokatalytische reactie weinig product aanwezig is, komt de reactie traag op gang. Naarmate de reactie vordert neemt de snelheid toe. De curve van concentratie van het product versus tijd heeft typisch een sigmoïdale vorm.
Een voorbeeld van een in de natuur voorkomende autokatalysator zijn groep II intronen (RNA).
Veel autokatalytische reacties zijn ontledingsreacties. Een van de eerste autokatalytische reacties die werd beschreven is de ontleding van zilveroxide:[1]
2 Ag2O → 4 Ag + O2.
Kruiskatalyse
Een verwante vorm van katalyse is kruiskatalyse, waarin meerdere stoffen elkaars vorming katalyseren. Dit kan symmetrisch zijn: twee stoffen die de vorming van elkaar katalyseren; of asymmetrisch: een stof die de vorming van een andere stof katalyseert, maar waarvan de vorming niet gekatalyseerd wordt door de andere stof.
Hypercyclus
Wanneer twee of meer autokatalytische stoffen tevens elkanders kruiskatalysator zijn spreekt men van een hypercyclus. Volgens Nobelprijswinnaar Manfred Eigen en Peter Schuster is de hypercyclus een principe van zelforganisatie en speelt ze een belangrijke rol in de evolutie van zelfreplicatie en dus van het leven.[2]
Externe links
- K. Lehmann en U. Schmidt. "Group II introns: structure and catalytic versatility of large natural ribozymes.", Crit Rev Biochem Mol Biol. (2003); 38(3): 249-303. PMID 12870716
- Andrew J. Bissette en Stephen P. Fletcher. "Mechanisms of Autocatalysis". Angew. Chem. Int. Ed. (2013), nr. 52, blz. 12800-12826. DOI:10.1002/anie.201303822
Bronnen, noten en/of referenties
|