Ammoniumijzer(II)sulfaat
Ammoniumijzer(II)sulfaat, meestal Mohrs zout genoemd en het daarmee ook stilzwijgend als hexahydraat aangeduid, is een dubbelzout met als brutoformule (NH4)2Fe(SO4)2. Het komt vrijwel steeds voor als het hexahydraat: (NH4)2Fe(SO4)2 · 6 H2O. Mohrs zout vormt lichtgroene kristallen. De naam van de stof is afgeleid van die van de Duitse scheikundige Karl Friedrich Mohr. Als Mohrs zout is ammoniumijzer(II)sulfaat een van de weinige tamelijk lucht-stabiele ijzer(II)verbindingen.
Ammoniumijzer(II)sulfaat
| ||||
| Structuurformule en molecuulmodel | ||||
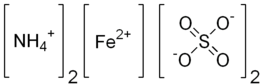 | ||||
Structuurformule van ammoniumijzer(II)sulfaat | ||||
Ammoniumijzer(II)sulfaat-kristallen (hexahydraat) | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | (NH4)2Fe(SO4)2 | |||
| IUPAC-naam | ammoniumijzer(II)sulfaat | |||
| Andere namen | Mohrs zout | |||
| Molmassa | 284,04712 g/mol | |||
| CAS-nummer | 10045-89-3 | |||
| EG-nummer | 233-151-8 | |||
| PubChem | 24863 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| LD50 (ratten) | (oraal) 3250 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | lichtgroen | |||
| Dichtheid | 1,86 g/cm³ | |||
| Smeltpunt | (ontleedt) 100 °C | |||
| Oplosbaarheid in water | (bij 20°C) 269 g/l | |||
| Goed oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | monoklien | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Synthese
Mohrs zout kan bereid worden door het oplossen van equivalente hoeveelheden ijzer(II)sulfaat en ammoniumsulfaat in water, dat een kleine hoeveelheid zwavelzuur bevat. Na indampen van de oplossing worden lichtgroene kristallen verkregen. Als alternatief voor het indampen kunnen de zouten in een warme oplossing samengevoegd worden. Na afkoelen ontstaat een neerslag van Mohrs zout.
Toepassingen
Het zout wordt gebruikt bij chemische analyses, zoals de CZV-bepaling. In de tuin wordt de stof gebruikt als bestrijdingsmiddel tegen mos in gazons.
De belangrijke component in deze verbinding is steeds het ijzer(II)-ion. Hoewel ijzer(II)sulfaat zelf ook gebruikt zou kunnen worden bij chemische analyses, heeft het gebruik van Mohrs zout het voordeel dat deze stof veel stabieler is tegen oxidatie door luchtzuurstof. Daarom wordt Mohrs zout ook als oertiterstof bij redoxtitraties aangewend.
