Waterstofchloraat
Waterstofchloraat of chloorzuur HClO3 is een oxozuur, met als anion het chloraat-ion. Het behoort tot de groep der halogeenzuurstofzuren. Het is een sterke oxidator en kan spontaan ontleden zodra het in te hoge concentratie voorkomt. Dat is een explosieve reactie waarbij onder andere chloorgas ontstaat. Chloraten dienen derhalve niet gemengd te worden met sterke zuren.
Waterstofchloraat
| ||||
| Structuurformule en molecuulmodel | ||||
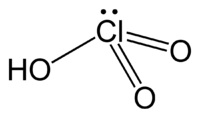 | ||||
Structuurformule van waterstofchloraat | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | HClO3 | |||
| IUPAC-naam | waterstofchloraat | |||
| Andere namen | chloorzuur, chloor(V)zuur | |||
| Molmassa | 84,45914 g/mol | |||
| SMILES | OCl(=O)=O | |||
| InChI | InChI=1/ClHO3/c2-1(3)4/h(H,2,3,4)/f/h2H | |||
| CAS-nummer | 7790-93-4 | |||
| EG-nummer | 232-233-0 | |||
| PubChem | 19654 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H271 - H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P220 - P280 - P305+P351+P338 - P310 | |||
| VN-nummer | 2626 | |||
| Fysische eigenschappen | ||||
| Dichtheid | (40% oplossing) 1,282[1] g/cm³ | |||
| Smeltpunt | (18% oplossing) 20 °C | |||
| Oplosbaarheid in water | (20°C) > 400 g/l | |||
| Goed oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKa = −2,7[2] | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Chloorzuur is betrekkelijk stabiel in een koude waterige oplossing tot een concentratie van circa 30%. Een concentratie tot 40% kan bereikt worden onder verlaagde druk. Hogere concentraties en verwarming leiden tot onder meer de volgende (explosieve) reacties waarbij onder andere perchloorzuur HClO4 ontstaat:
Productie
Chloorzuur kan worden gemaakt door bariumchloraat te mengen met verdund zwavelzuur.[3]
Een andere bereidingswijze is verhitten van waterstofhypochloriet:
Bronnen, noten en/of referenties
|

