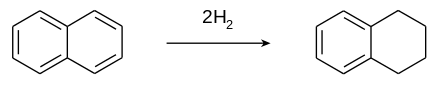Tetraline
Tetraline of tetrahydronaftaleen is een kleurloze olie-achtige koolwaterstof met als brutoformule C10H12. Ten opzichte van naftaleen heeft het molecule vier waterstofatomen extra.
Tetraline
| ||||
| Structuurformule en molecuulmodel | ||||
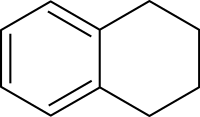 | ||||
Structuurformule van tetraline | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | C10H12 | |||
| IUPAC-naam | tetraline | |||
| Andere namen | tetrahydronaftaline | |||
| Molmassa | 132,20 g/mol | |||
| SMILES | C1CCC2=CC=CC=C2C1 | |||
| CAS-nummer | 119-64-2 | |||
| Vergelijkbaar met | naftaleen, tolueen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H411 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,89 g/cm³ | |||
| Smeltpunt | −35,8 °C | |||
| Kookpunt | ~207 °C | |||
| Dampdruk | (bij 20°C) 20 Pa | |||
| Goed oplosbaar in | organische oplosmiddelen | |||
| Slecht oplosbaar in | water | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tetraline kan uit steenkoolteer gewonnen worden. Het wordt samen met decaline als oplosmiddel gebruikt. Verder wordt het als koelmiddel in de productie van etheenoxide gebruikt. Tetraline kan ook geoxideerd worden tot tetralon.
Synthese
Tetraline wordt geproduceerd door de hydrogenering van naftaleen:
De omzetting van naftaleen in tetraline is uitgebreid onderzocht. Mengsels met verschillende hoeveelheden naftaleen, tetraline en decaline worden verkregen door de druk, temperatuur of katalysator van het proces te wijzigen. Als katalysator wordt gebruikgemaakt van een mengsel van wolfraam(IV)sulfide, nikkel(II)sulfide en aluminiumoxide of een mengsel van kobalt(II)oxide, molybdeen(VI)oxide en aluminiumoxide. De druk kan variëren van 50 tot 300 atmosfeer. De omzettingsgraad van de reactie wordt tot 60-70 atm bepaald door de activiteit van de katalysator. Met de genoemde katalysatormengsels wordt een optimum bereikt tussen 300 en 370 °C.[1]
Isotetraline
Wanneer naftaleen wordt gereduceerd met behulp van de Birch-reductie, dan wordt isotetraline (1,4,5,8-tetrahydronaftaleen) verkregen.
Externe links
- (en) MSDS van tetraline
Bronnen, noten en/of referenties
|