Hydroxonium
Het hydroxonium-ion, ook bekend als oxonium- of hydronium-ion, is het kation dat gevormd wordt wanneer water (H2O) een waterstofion (H+) opneemt. De brutoformule is daarom H3O+. De eigendissociatie of autoprotolyse van water verloopt volgens een evenwichtsreactie:
- H2O + H2O H3O+ + OH−
Hydroxonium
| ||||
| Structuurformule en molecuulmodel | ||||
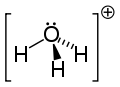 | ||||
Structuurformule van hydroxonium | ||||
 | ||||
Molecuulmodel van hydroxonium | ||||
| Algemeen | ||||
| Molecuulformule (uitleg) | H3O+ | |||
| IUPAC-naam | oxonium | |||
| Andere namen | hydronium | |||
| Molmassa | 19,02322 g/mol | |||
| SMILES | [OH3+] | |||
| InChI | 1S/H2O/h1H2/p+1 | |||
| CAS-nummer | 13968-08-6 | |||
| PubChem | 123332 | |||
| Evenwichtsconstante(n) | pKa = −1,7 | |||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Het hydroxonium-ion is daarmee volgens de theorie van Johannes Nicolaus Brønsted het geconjugeerde zuur van water:
- HZ + H2O Z− + H3O+
Het hydroxonium-ion heeft een pKa-waarde (zuurconstante) van −1,7 en is het sterkste zuur dat in water kan bestaan. Een nog sterker zuur, zoals zoutzuur (HCl), zal een proton afgeven aan water, dat zo in een hydroxonium-ion omgezet worden. De pH van een waterige oplossing wordt dus uitsluitend bepaald door de H3O+-concentratie (of correcter: de activiteit van de hydroxonium-ionen) in de oplossing.
Het waterstofion of proton (H+) komt in water eigenlijk altijd gehydrateerd voor. Dit wordt in chemische reacties vaak, maar beslist niet altijd, genoteerd als H3O+. Beide notaties worden naast, en soms door elkaar gebruikt. Vooral in de organische synthese wordt van de notatie H+ gebruikgemaakt. Hydroxonium verwijst eigenlijk enkel naar een gehydrateerd waterstofion. Wanneer de nadruk gelegd moet worden op de zuur-base-eigenschappen, is H3O+ een praktische beschrijving.
De werkelijkheid is echter complexer. Een proton is in water niet aan slechts één watermolecule gebonden. Formules als H5O2+, H7O3+ en H9O4+ vormen een reeks waarin de werkelijke toestand van protonen in water steeds beter beschreven wordt.[1] Water dient dus formeel gezien te worden als een verzameling van clusters van geprotoneerde watermoleculen.
Voor veel reacties waarin een waterstofion noodzakelijk is om de reactie uit te voeren, zonder dat de nadruk gelegd wordt op de zuur-base-aspecten van de reactie, wordt de reactievergelijking vaak een stuk eenvoudiger als de hydratatie-mantel, net als bij gewone ionen, weggelaten wordt. Vergelijk
- MnO4− + 8 H3O+ + 5 e− → Mn2+ + 12 H2O
met
- MnO4− + 8 H+ + 5 e− → Mn2+ + 4 H2O
Bronnen, noten en/of referenties
|