Valentie-elektron
Een valentie-elektron is een elektron dat zich in een nog niet helemaal opgevulde elektronenschil, de valentieschil, van een atoom bevindt.
Valentie
De valentie-elektronen worden door de al wel volle schillen van de positieve atoomkern afgeschermd. De valentie-elektronen "zien" dus een kernlading die veel kleiner is dan de werkelijke lading, en bovendien bevinden zij zich veel verder van de atoomkern. Valentie-elektronen worden daarom makkelijk afgestaan. Chemische elementen met evenveel valentie-elektronen staan onder elkaar in het periodiek systeem en hebben gelijkaardige chemische eigenschappen.
Natrium
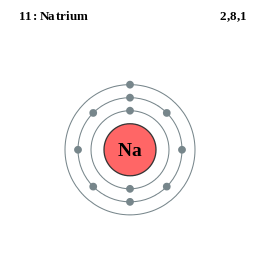
In het natriumatoom (zie figuur hiernaast) vullen de eerste 10 elektronen samen de eerste twee schillen volledig op. Het elfde elektron dat nodig is om het atoom neutraal te maken is het valentie-elektron, het is boven in de derde schil getekend. Het bevindt zich in de volgende baan, ver van de kern. Het negatieve valentie-elektron "ziet" de positieve kern nauwelijks: de 11+ kern wordt door 10 elektronen effectief tot een 1+ kern gereduceerd. Het valentie-elektron wordt daardoor makkelijk afgestaan, natrium komt in de natuur uitsluitend voor als eenwaardig positief ion: het valentie-elektron maakt deel uit van de elektronen rond een ander atoom, chloor bijvoorbeeld.
Chloor
In het chlooratoom treffen we een vergelijkbare situatie aan: de eerste 10 elektronen vullen de eerste twee schillen, de overige 7 vormen de derde, de valentieschil. Chloor beschikt over 7 valentie-elektronen. De valentieschil kan 8 elektronen bevatten en is dan (voorlopig) vol, er is dus nog ruimte voor een extra elektron. Er is één groot verschil met de situatie bij het natriumatoom: de atoomkern wordt nog steeds door 10 elektronen afgeschermd, maar is nu zelf 17+. De elektronen in de valentieschil wordt stevig gebonden en een extra elektron kan ook "profiteren" van de netto 7+ lading (17 - 10) van de chloorkern. Het chlooratoom neemt makkelijk een elektron op en komt in de vrije natuur eigenlijk alleen maar als eenwaardig negatief ion, als Cl−, voor.
Andere elementen
- Voor de andere elementen in de kolom van het periodieksysteem waarin natrium staat geldt hetzelfde: ze hebben allemaal 1 valentie-elektron en staan dat makkelijk af.
- De elementen in de kolom van beryllium hebben twee valentie-elektronen, die eveneens makkelijk afgestaan worden.
- Voor de elementen in de kolom van chloor geldt hetzelfde als voor chloor: ze nemen makkelijk 1 extra elektron op in hun valentieschil.
- Voor de andere hoofdgroepkolommen gelden gelijksoortige argumenten. Als de valentieschil half bezet is (de kolom van koolstof) is zowel opnemen als afstaan van valentie-elektronen geen echte optie. De valentie-elektronen worden meestal gedeeld in een covalente binding.
Overgangsmetalen
Voor de overgangsmetalen is de situatie ingewikkelder, omdat naast de buitenste niet helemaal gevulde schil ook de erbinnen gelegen (sub)schil niet helemaal vol is. Het aantal valentie-elektronen kan tot 18 oplopen.
Valentieband
In vaste stoffen kunnen de elektronenbanen uit de valentieschillen van afzonderlijke atomen met elkaar een gebied vormen waarin de valentie-elektronen zich vrijwel ongehinderd kunnen bewegen. Dit wordt de valentieband genoemd.
Aan elektrische geleiding in p-halfgeleiders doen valentie-elektronen mee. Normaal doen alleen conductie-elektronen van de geleidingsband mee aan geleiding.
Notatie
De valentie-elektronen komen in paren voor als het er meer dan 4 zijn. Als er zich bijvoorbeeld 5 elektronen in de buitenste schil bevinden vormen twee elektronen samen een elektronenpaar. Er zijn dan nog maar 3 van de 5 elektronen vrij om een covalente binding aan te gaan, waarin een gemeenschappelijk elektronenpaar gedeeld wordt.
Niet-gepaarde elektronen worden aangegeven met een punt. Elektronenparen worden getekend als een "|" of "_", afhankelijk van de positie ten opzichte van het elementsymbool. Steeds wordt wel aangegeven dat het element van die kant eigenlijk niet benaderd kan worden, afgesloten is.