Goud
Goud is een scheikundig element met symbool Au (aurum) en atoomnummer 79. Het is een geel metalliek overgangsmetaal. Het is al sinds de stroomculturen (Nabije Oosten van 3500 v.Chr. tot 800 v.Chr.) zeer gewaardeerd en is roestvrij, daarom wordt goud soms "de koning der metalen" genoemd.
Eigenschappen
Goud behoort tot de edelmetalen en is een dicht maar zacht metaal, net iets harder dan zink. Voor het gebruikt kan worden, moet het gezuiverd worden en voor de meeste doeleinden wordt het gelegeerd met andere materialen om het harder te maken. De zuiverheid van goud voor sieraden wordt gemeten in karaat; zuiver goud is 24 karaat. Veel voorkomende zuiverheidsgraden in Nederland zijn 14 karaat (58,3% goud), 18 karaat (75%) en 22 karaat (91,7%).
Goud wordt al lange tijd als waardevol metaal gezien. In Egyptische hiërogliefen van de 26e eeuw v.Chr. wordt al melding gemaakt van goud als betaalmiddel. Tot ongeveer halverwege de 20e eeuw na Chr. werd goud nog veelvuldig gebruikt voor munten.
In de oudheid was goud niet alleen bekend als waardevol, maar ging er ook magie van uit en stond het symbool voor zuiverheid. Alchemisten zijn lange tijd op zoek geweest naar de steen der wijzen, om andere materialen te transformeren in goud. Dat zij daar nooit in zijn geslaagd, is vanuit de huidige inzichten over de opbouw van atomen goed te verklaren.
In de 19e eeuw zijn er vooral in de Verenigde Staten en Australië veel rijke goudbronnen ontdekt, hetgeen leidde tot goldrushes. Bekende voorbeelden zijn de Californische goldrush en de Goldrush van Klondike.
Het symbool van goud Au is de afkorting van het Latijnse aurum. De naam goud is afgeleid van de Indo-europese wortel ĝhel- waarvan ook geel afkomstig is.[1]
Opmerkelijke eigenschappen



Metallisch goud heeft een gele glanzende kleur. Zeer fijn verdeeld kan het ook andere kleuren zoals zwart of donkerpaars aannemen. Van alle bekende metalen die bij kamertemperatuur vast zijn, is goud, na lood, het makkelijkst te buigen en te vervormen. Een blokje goud van 1 gram (een kubusje met zijden van 3,73 mm) kan worden geplet en gewalst tot een plaat bladgoud met een oppervlakte van 1 vierkante meter. Bladgoud kan gelijmd worden op voorwerpen waardoor ze verguld worden. Het is tevens mogelijk om goud door middel van elektrolyse op voorwerpen aan te brengen.
Goud is een zeer goede elektrische en thermische geleider en vrijwel inert. De dichtheid van goud (19.320 kg/m3) is bijna tweemaal zo groot als die van lood (11.300 kg/m3).
Goudchemie
Goud staat bekend als een inert edelmetaal dat weinig reactiviteit vertoont; het reageert bijvoorbeeld niet met zuurstof. Toch zijn er redelijk wat goudverbindingen bekend zoals goudhalogeniden en goudchalcogeniden. Het metaal is oplosbaar in koningswater waarbij het een AuCl4−-ion vormt. Met zwaardere elementen, zoals telluur, is de reactiviteit zelfs vrij groot.
Goud vormt in de regel verbindingen met een oxidatiegetal +1 of +3. Er is echter ook een klein aantal verbindingen waarin het zelf als oxidator optreedt en oxidatiegetal −1 aanneemt, de auriden.
Calaveriet (goudtelluride) is een mineraal en gouderts.
Verschijning
Door de relatieve inertheid komt goud veelal in ongebonden vorm in de natuur voor. Meestal komt het voor als sporenelement in mineralen, maar soms ook in de vorm van goudnuggets (goudklompjes)[2], en ook weleens in de vorm van een grote goudklomp. De grootste goudklomp die ooit is gevonden is de Welcome Stranger Nugget met een gewicht van ruim 71 kilo. Deze werd in 1869 gevonden in Moliagul, Victoria, Australië op bijna een meter diepte, en is omgesmolten. De Serra Pelada (Canaã) Nugget werd gevonden in 1983 in de buurt van Serra Pelada, Pará, Brazilië. Met een gewicht van ruim 61 kilo is deze de grootste nog in zijn oorspronkelijke vorm bestaande goudklomp.[3]
In vrijwel de gehele aardkorst komt goud in zeer lage concentraties voor in de mineralen petziet, calaveriet en sylvaniet. De hoeveelheden zijn echter voor commerciële winning volstrekt onrendabel.
De hoogste concentraties worden sinds 1880 gevonden in Zuid-Afrika. Andere grote goudmijnen bevinden zich in Nevada en South Dakota in de Verenigde Staten. Bij de belangrijkste goudproducerende landen horen (in 2001) ook Australië, Indonesië en Volksrepubliek China. Ongeveer twee derde van de winning gebeurt in open mijnen (dagbouw) en geeft grote hoeveelheden afval. De jaarproductie uit de mijnen lag in de jaren 2010 tot en met 2017 tussen de 2745 en 3270 ton of ten minste twee derde van het totale aanbod. Door de winning van het goud van een ring van 10 gram met een gehalte van 18 karaat ontstaat 18.000 kg afval. Recycling van oud goud levert een kwart tot een derde van het totale aanbod.
Twee bekende goudwinningsmethoden gebruiken het giftige natriumcyanide en eveneens giftige kwik door het goud eerst op te lossen volgens:
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 NaAu(CN)2 + 4 NaOH.
Het giftige natriumcyanide heeft onder andere een grote milieuramp veroorzaakt bij de Summitville mijn in Rio Grande County, Colorado in de Verenigde Staten.
Vooral vroeger werd kwik gebruikt omdat goud daarin oplost (goud-kwik amalgaam).
Gewoonlijk komt goud voor als fijne korrels, verspreid in een gesteente. Om zichtbaar te zijn voor het blote oog moet de verhouding goud in gouderts meer dan 30 mg/kg (30 ppm) bedragen. Voor de meeste goudmijnen betekent dit dat het goud in het erts niet zichtbaar is.
Ontstaan
Goud is al aanwezig op Aarde sinds het ontstaan van de planeet zelf, maar het is niet gevormd op Aarde omdat voor de productie ervan fusiereacties nodig zijn. Er vinden kernfusiereacties plaats in de kern van sterren, maar deze kernfusiereacties voorzien niet in genoeg energie voor de productie van goud. Sterren die zwaar genoeg zijn (vanaf ongeveer 8 keer de massa van de Zon) beëindigen hun leven in een supernova-explosie. Tijdens deze explosie worden er door middel van kernreacties zware metalen gevormd, waaronder goud.[4] Na de explosie worden stofdeeltjes met daarin minuscule beetjes goud de ruimte in geslingerd. Wanneer de stofdeeltjes in het zwaartekrachtveld van een ster zoals de Zon komen tijdens het ontstaan van de planeten zullen de stofdeeltjes onderdeel worden van de samenklonterende materie die rond de ster die uiteindelijk planeten vormen.
Isotopen
| Stabielste isotopen | |||||
|---|---|---|---|---|---|
| Iso | RA (%) | Halveringstijd | VV | VE (MeV) | VP |
| 195Au | syn | 168,10 d | EV | 1,220 | 195Pt |
| 197Au | 100 | stabiel met 118 neutronen | |||
Er is één stabiele isotoop van goud bekend en ongeveer 18 instabiele, waarvan 195Au met een halveringstijd van ruim 168 dagen het stabielst is.
Toxicologie en veiligheid
Voor het menselijk lichaam is zuiver goud onschadelijk en de meeste goudverbindingen zijn niet bijzonder giftig. Lever- en nierbeschadigingen, dermatitis en colitis kunnen echter ontstaan bij relatief hoge doses goudverbindingen (in de orde van grootte van wekelijks enkele tienden van een gram) zoals nodig bij de behandeling van reumatoïde artritis, soms met dodelijke afloop.[5] Soms wordt beweerd dat colloïdaal goud kan worden opgenomen door zogenaamde macrofagen, cellen die een belangrijke rol spelen bij het op gang houden van ontstekingsprocessen (zoals bij RA), waarna deze worden gedood (en de ontsteking wordt geremd). Hiertoe wordt dit goud veelal geïnjecteerd in patiënten (omdat hoge doses nodig zijn voor effect). Het werkelijke effect van colloïdaal goud op mensen is echter nooit goed onderzocht.[6]
Het menselijk lichaam (bij een gewicht van 70 kg) bevat van nature ca. 0,2 mg goud.[7]
Toepassingen
Sinds de 20e eeuw is goud praktisch onmisbaar in de industrie. Enkele toepassingen zijn:
- Kwalitatief hoogwaardige elektrische schakelaars en connectoren.
- In de ruimtevaart als coating voor kunstmanen omdat goud ultraviolette straling goed reflecteert.
- Vanwege de hoge dichtheid, als gewicht in een zelfopwindend horloge, in de hogere prijsklasse.[8]
- In veel elektronische componenten wordt goud gebruikt.
- De radioactieve isotoop 195Au wordt gebruikt bij kankeronderzoek.
- Kronen in de tandheelkunde.
- Hoewel het veelal is vervangen door andere metalen wordt in sommige monetaire stelsels goud (nog) gebruikt voor muntgeld.
- Als dekking van papiergeld (zilver wordt daarbij ook gebruikt).
- De mooie glans en de goede corrosiebestendigheid maken goud een gewild metaal voor sieraden.
- Goud is vanwege zijn glans en schaarsheid een symbool van weelde. Huishoudelijke voorwerpen werden dan ook soms van goud gemaakt of verguld. Hetzelfde gold voor kunstwerken.
- Borduurwerk (brokaat) met gouddraad, eigenlijk slagmetaal.
Kunst- en gebruiksvoorwerpen zoals klokken en kandelaars werden in het verleden verguld door dampen van in kwik opgelost goud (amalgaam) op het voorwerp te blazen, waarbij het kwik verdampte en het goud in een dunne laag neersloeg. Dit is niet meer toegestaan door de ernstige giftigheid van deze dampen.
Ongeveer de helft van het goud wordt verwerkt in juwelen en slechts 10% heeft een industriële bestemming. Als zuiver metaal is goud vrijwel onbruikbaar voor industriële toepassingen doordat het erg zacht is. In plaats daarvan wordt het veelvuldig gebruikt in legeringen omdat het element over uitstekende elektrische eigenschappen beschikt en zeer corrosiebestendig is.
Goud als belegging
Veel beleggers gebruiken goud als een belegging en ongeveer een derde van het goud wordt jaarlijks hiervoor opzijgelegd. Tot slot kopen de centrale banken per jaar ongeveer een tiende van het goudaanbod op en stoppen dit in de kluizen. India en de Volksrepubliek China zijn de grootste kopers van goud.
Omdat goud waardevast is, stijgt de vraag naar goud wanneer de economie in een crisis verkeert en andere beleggingen als riskant worden gezien. Hierdoor stijgt de goudprijs in tijden van economische onzekerheid, men zegt in de financiële wereld ook wel dat 'goud van instabiliteit houdt'. Wanneer de economie verbetert verkopen beleggers hun goud weer om terug te keren naar andere investeringen die een beter rendement bieden en waarvan het risico weer binnen de perken is, en de goudprijs daalt weer. Er bestaat dan ook een goudcyclus die tegengesteld aan de economische conjunctuur verloopt.
Consumptie van goud
Er zijn verschillende dranken waarin goud verwerkt is. Dit betreft 24-karaats bladgoud.
- goudlikeur:
- sake: Kimpun Sake
- wijn: Luxor champagne
- Ook zijn er bonbons te koop, waarin bladgoud is verwerkt.[9][10] In sommige restaurants wordt bladgoud aan gerechten zoals desserts toegevoegd.
- Als kleurstof voor voedingsmiddelen is goud bekend onder het E-nummer E175.
Prijsontwikkeling

Tot medio 1971 speelde goud een cruciale rol in het internationale financiële systeem. De waarde van de valuta waren direct of indirect in goud uitgedrukt en de centrale bankiers bepaalden de prijs van het goud. De prijs van goud was decennia lang heel stabiel. De Amerikaanse president Richard Nixon maakte hieraan op 15 augustus 1971 een einde, zijn maatregel staat nog bekend als de Nixon-schok. Na de Nixon-schok is de prijs van goud een kwestie van vraag en aanbod. Op de internationale goederenmarkten wordt de goudprijs uitgedrukt in Amerikaanse dollars per troy ounce, dat is iets meer dan 31,1 gram. In 1980 bereikte de goudprijs een record van 887 dollar per troy ounce. In 2011 bereikte de goudprijs een nieuw nominaal record van 1900 dollar per troy ounce, gecorrigeerd voor inflatie was dit nog altijd iets lager dan het oude record.
Sinds de top van 1980 heeft het goud in een zogenoemde ‘bear market’ gezeten. Na de grote inflatie van eind jaren zeventig en begin jaren tachtig steeg de prijs van goud naar een recordhoogte van US$887 per ounce. Hierna daalde de goudprijs naar een dieptepunt van US$254 per ounce in 2001, om vervolgens aan een ongekende klim te beginnen. Deze klim is te danken aan het feit dat wereldwijd duidelijk werd bij de grote investeerders en economen dat de Verenigde Staten zich diep in de schulden aan het steken was en deze financierde via hun eigen valuta via de Federal Reserve (FED). De toevlucht is versterkt door de eurocrisis. Hierdoor is te merken dat er een toevlucht is naar fysiek goud. Beleggingsgoud wordt geleverd in munten, zoals de krugerrand, of in baarvorm. Tegenwoordig kan men ook in Gold exchange-traded funds (GETF) beleggen.
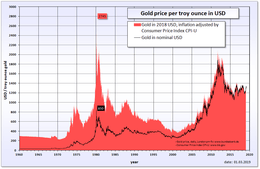
| Jaar[11] | Gemiddeld | Mutatie |
|---|---|---|
| 1970 | 35,9 | - |
| 1975 | 161,0 | 348% |
| 1980 | 612,6 | 280% |
| 1985 | 217,3 | −65% |
| 1990 | 383,5 | 76% |
| 1995 | 384,2 | 0% |
| 2000 | 279,1 | −27% |
| 2005 | 444,7 | 59% |
| 2010 | 1224,5 | 175% |
| 2011 | 1571,5 | 28% |
| 2012 | 1669,0 | 6% |
| 2013 | 1411,2 | −15% |
| 2014 | 1266,4 | −10% |
| 2015 | 1160,1 | −8% |
| 2016 | 1250,7 | 8% |
| 2017 | 1257,1 | 1% |
| 2018 | 1268,5 | 1% |
| 2019 | 1392,6 | 10% |
Taal
Het stoffelijk bijvoeglijk naamwoord van goud is gouden. Het oudere gulden wordt soms ook nog gehoord. Bedekt men iets met een laagje goud of goudverf, dan heet dat vergulden. Het woord goud heeft in het taalgebruik zijn plaats veroverd als "waardevol" en/of "duurzaam", of wordt anders figuurlijk gebruikt, bijvoorbeeld:
- Een gouden bruiloft staat voor een 50-jarige huwelijksverjaardag
- Een gouden jubileum staat voor een 50-jarig jubileum
- De gouden medaille staat symbool voor de eerste plaats
- De gouden plaat, voor veelverkochte muziekalbums
- De Gouden Eeuw
- De gulden snede
- Het Gulden Vlies
- De valuta gulden, oorspronkelijk een gouden munt.
Klatergoud, kattengoud, goudglimmer
Het woord klatergoud betekent iets dat men voor goud of iets waardevols wil laten doorgaan maar het feitelijk niet is. Een voorbeeld daarvan is het mineraal pyriet (vgl. Engels: fool's gold, Duits: narrengold), dat door zijn goudachtige uiterlijk geliefd was bij pseudoalchemisten en kwakzalvers. Ook kattengoud is nepgoud — katten staan bekend als vals —, alleen verwijst dit naar geel mica of, gewestelijk, naar gele hars. Geel mica staat ook bekend onder de naam goudglimmer.[12]
De term goud in biologische benamingen
Het woord goud wordt ook in de biologie gebruikt om dieren en planten een naam te geven. De naam 'gouden' kan zowel slaan op een gele kleur als op een goudachtige glans, vaak wordt het Latijnse aurata gebruikt. Voorbeelden zijn de plant goudenregen (Laburnum anagyroides) en de gouden pijlgifkikker (Dendrobates auratus), vanwege hun gele kleuren, en de gouden tor (Cetonia aurata), vanwege de metallieke glans.
Externe links
- Lenntech.nl - Goud
- (en) EnvironmentalChemistry.com - Goud
- (en) WebElements.com - Goud
- (en) World Gold Council, een economische website over goud
| Zie de categorie Gold van Wikimedia Commons voor mediabestanden over dit onderwerp. |
Bronnen, noten en/of referenties
|
| Kopergroep |
|---|
|
Koper · Zilver · Goud · Röntgenium |
| Chemische elementen en isotopen | ||||||
|---|---|---|---|---|---|---|
|

