| Basiskennis chemie |
|
Chemie en Stoffen
Chemisch Rekenen
Naamgeving zouten
Hoeveel?
|
Titrimetrie
| In de titrimetrie of volumetrie wordt met behulp van een titratie de hoeveelheid van een stof vastgesteld. Om bijvoorbeeld de hoeveelheid van een base - het tegenovergestelde van een zuur, dus een stof die zuur neutraliseert - vast te stellen wordt van een zeer zuiver zuur een hoeveelheid afgewogen en opgelost in water. Daarna wordt langzaam een oplossing van de te testen base toegevoegd. Als de base al het zuur geneutraliseerd heeft stop je en kun je uitrekenen hoeveel base er in de toegevoegde oplossing zat. Een base word ook wel loog genoemd.
Titraties worden uitgevoerd met behulp van een buret. In zijn meest eenvoudige vorm is dit een glazen buis met aan een kant een kraan en een schaalverdeling. De buis wordt verticaal opgesteld met de kraan onderaan. Door voor de titratie de schaal af te lezen én als je stopt, kun je het volume reagens dat je hebt toegevoegd uirekenen. Het reagens wordt in een titratie meestal titrant genoemd. |
Titrimetrie Volumetrie Base Loog Titrant |
De reactie tussen een zuur en een base is niet het de enige type reactie die in de titrimetrie gebruikt wordt. Afhankelijk van de gebruikte titratiereactie worden namen gebruikt als
|
Titratiesoorten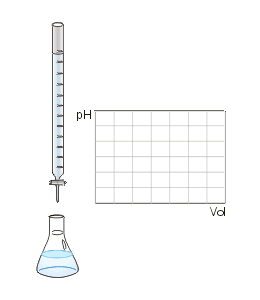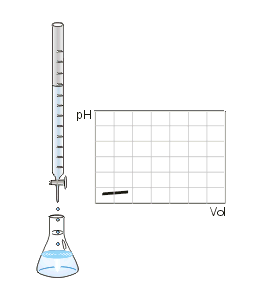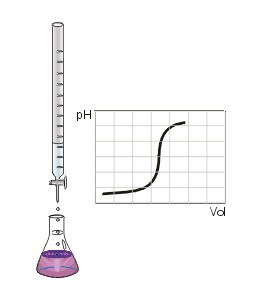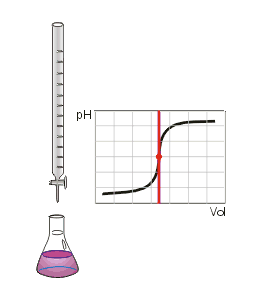 |
Voorbeeld van een zuur-base-titratie
| Om de concentratie van natronloog te bepalen - het hydroxide-ion is hier de base - wordt een titratie uitgevoerd waarbij kaliumwaterstofftalaat () als zuur gebruikt wordt. Kaliumweaterstofftalaat wordt vaak afgekort als .[1] De volgende reactie treedt op:
|
Zuur-Base-titratie Kaliumwaterstofftalaat KHFt |
Waarom een titratie
| Natriumhydroxide is een witte hygroscopische stof. Dit wil zeggen dat vast natriumhydroxide heel makkelijk water uit de omgeving (lucht) aantrekt. Van een afgewogen hoeveelheid natriumhydroxide weet je daarom nooit hoeveel mol NaOH je nu eigenlijk hebt, en hoeveel water er ook meegewogen is. | Natriumhydroxide Hygroscpie |
Wanneer moet je stoppen, indicator
| Een van de nadelen van kaliumwaterstofftalaat en natriumhydroxide is dat beide vaste zuivere stoffen wit zijn. Ook zuiver is een witte vaste stof. Net als keukenzout en kristalsuiker lossen deze witte stoffen op in water en is de oplossing vervolgens kleurloos. Hoe weet je dat je voldoende base hebt toegevoegd aan het zuur?
Om dit duidelijk te maken wordt gebruik gemaakt van stoffen die in een zure omgeving aan andere kleur hebben dan in een basische omgeving. Zulke stoffen worden indicator genoemd (vergelijk het Engelse "to indicate", aanwijzen). Een veel gebruikte indicator is fenolftaleïne. Deze stof heeft in zuur milieu geen eigen kleur, is kleurloos. In een basische omgeving is de stof paars gekleurd. In het plaatje onder 'Titratiesoorten is dit aangegeven door de kleurverandering bij het eindpunt van de titratie. Het eerste beetje base teveel, en dat is echt maar een heel klein, verwaarloosbaar klein beetje, zal tot gevolg hebben dat de indicator van kleurloos naar paars verkleurd. Dit verschil is goed te zien, en je weet dat je stoppen moet. Meteen stoppen bij de eerste roze kleur die je ziet moet niet. Op de plek waar de druppel titrant in de oplossing valt zal de oplossing meteen basisisch worden, en de indicator dus roze. Ga je vervolgens de oplossing mengen dan zorgt het zuur dat nog in de rest van de oplossing aanwezig is ervoor dat de oplossing als geheel toch weer - iets minder - zuur wordt en fenolftaleïne dus weer kleurloos. |
Indicator Fenolftaleïne
|
Zuur in de lucht
Bij titraties met natronloog als titrant en fenolftaleïne als indicator staat altijd:
Titreer tot de roze kleur 30 seconden blijft. Omdat je stopt bij de eerste kleine hoeveelheid base die je (eigenlijk te veel) hebt toegevoegd is de oplossing basisch geworden. Dit betekent dat zuren makkelijk zullen oplossen in deze vloeistof. Uieraard voeg je niet expres extra zuur toe, maar in de lucht zit onder andere koolstofdioxide, . Alle levende wezens produceren dit gas als onderdeel van hun voedselverwerking en planten gebruiken het in de fotosynthese om er suiker en andere stoffen die ze nodig hebben mee te maken. Dit gas wordt ook wel koolzuurgas genoemd. Dit gas lost goed op in water, maar geeft dan ook meteen een reactie met het kleine beetje base dat daarin aanwezig is: Het hele kleine beetje base dat zorgt dat fenolftaleïne roze kleurt verdwijnt weer, en de indicator wordt weer kleurloos! |
Koolstofdioxide Koolzuurgas |
Rekenen
| Je weet nu welk volume natronloog je nodig had om de hoeveelheid afgewogen te neutraliseren. In onderstaand schema is aangegeven hoe je de concentratie van het natronloog berekent.
Eerst wordt aangegeven hoe je moet gaan rekenen, daarna wordt de berekening uitgevoerd. |
Berekening |
Stap 1 Hoe?
|
Concentratie |
Stap 2 Hoe?
|
Aantal mol |
- ↑ Ft is geen echt chemisch symbool, maar de stof wordt heel vaak gebruikt, waardoor de afkorting erg makkelijk is. Ft staat dus voor . Tijdens de reactie met natronloog reageert maar één van de waterstofatomen in KHFt!.